肺癌是发病率和死亡率最高的恶性肿瘤之一。化学药物治疗和免疫治疗是目前临床实践中广泛使用的治疗方式,但治疗过程中药物易产生系统性毒性和耐药性,并伴有全身不良炎症反应,因此,如何减少药物剂量并实现药物靶向递送已成为肺疾病治疗过程中亟待解决的难题。目前,通过小分子激动剂激活干扰素基因刺激因子(STING)是最有前景的免疫疗法策略之一,其机制是通过损伤双链DNA激活环磷酸鸟苷(GMP)-磷酸腺苷(AMP)(cGAMP)的合成,进而启动STING通路实现肿瘤原发性免疫治疗。然而,STING通路激活一直受到信号轴中关键分子cGAMP易于水解的困扰,因此,提升内源性cGAMP产生,并抑制其水解已成为高效激活STING通路的关键科学问题。
近日,基础医学院黄永伟教授团队和北京化工大学尹梅贞教授团队合作构建一类甲基磺酸酸化的苝酰亚胺衍生物治疗平台。该治疗平台一方面可利用苝酰亚胺衍生物触发内源性活性氧产生,引发肿瘤细胞DNA损伤,进而提升cGAMP产生效率;另一方面,通过甲基磺酸负离子抑制外核苷酸焦磷酸酶/磷酸二酯酶1(ENPP1)活性,减缓cGAMP水解。同时,该治疗平台可以实现肺选择富集,缓解疾病治疗过程中药物引发的系统性毒性和全身炎症反应,实现肺癌的化学-免疫治疗。该研究工作通过化学工具构建了一种以苝酰亚胺衍生物为骨架的“三合一”小分子STING激动剂,为包括肺癌在内的恶性肿瘤治疗提供了新的策略和平台,相关研究结果以“Sulfonated Perylene as Three-in-One STING Agonist for Cancer Chemo-Immunotherapy”为题发表在Angew. Chem. Int. Ed.(2024,63, e202318799)期刊上。
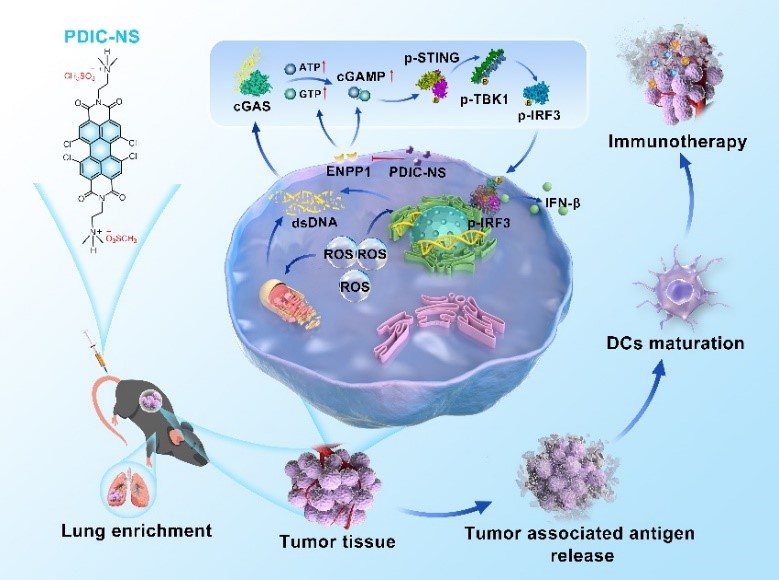
示意图:PDIC-NS诱导的DNA损伤激活cGAS-STING信号通路用于化学-免疫疗法
该研究成果河南大学为第一完成单位,河南大学博士研究生赵雪杰,已毕业硕士研究生郑日杰为共同第一作者,黄永伟教授和尹梅贞教授为通讯作者。研究工作得到国家自然科学基金、河南省杰出青年基金、河南省高校科技创新团队支持计划、河南大学青年交叉基金等项目的经费支持。
黄永伟教授近年来以苝酰亚胺衍生物等共轭有机小分子为研究对象,围绕重大肺疾病治疗开展系列研究工作。特别是,该团队创新性提出并完善了小分子化合物器官选择性递送的新策略,将苝酰亚胺衍生物应用拓宽至肿瘤和肺纤维化化学免疫治疗领域,并率先开展了其靶向作用蛋白分子的筛选工作,初步阐明了其治疗重大肺疾病的分子机制,为苝酰亚胺衍生物等有机小分子化合物后期开展临床研究和转化提供丰富理论依据和物质基础。相关研究成果先后在Adv. Funct. Mater. (2012, 22, 4149), Biomaterials (2019, 216, 119252), Adv. Mater. (2020, 32, 2001146), Angew. Chem. Int. Ed. (2021, 60, 16215), Small (2022, 18, 2104521), Angew. Chem. Int. Ed. (2023, 62, e202214586), Adv. Sci. (2023, 10, 2204498), ACS Nano (2023, 17, 22527), Adv. Healthc. Mater. (2024, 14, 2303837), Angew. Chem. Int. Ed. (2024, 63, e202318799) 等期刊发表。主持国家自然科学基金4项,主持河南省杰出青年基金项目、河南省自然科学基金重点项目、河南省高校科技创新团队项目等省厅级项目12项。以第一发明人授权国家发明专利10项,以第一完成人获得河南省科技进步奖叁等奖1项,河南省教育厅科技进步奖壹等奖1项,河南省自然科学学术论文壹等奖2项,贰等奖3项。
全文衔接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202318799